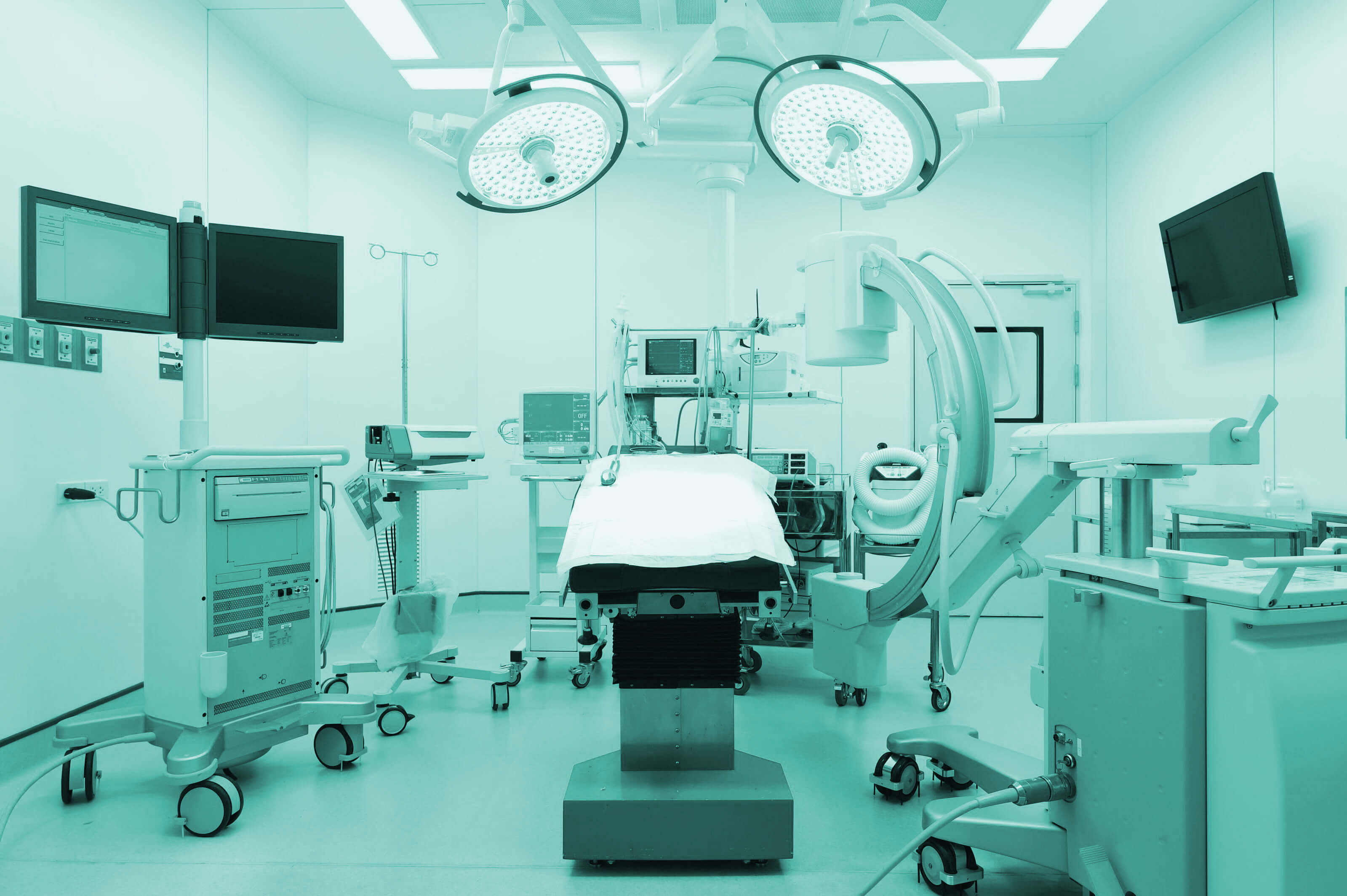
DQS Medizinprodukte GmbH menawarkan berbagai layanan di bidang persetujuan perangkat medis dan sertifikasi sistem manajemen dalam perawatan kesehatan. Dengan kompetensi, pengalaman, dan jangkauan layanan kami, kami dapat memberi Anda keunggulan kompetitif yang nyata. Nilai dan kepercayaan pada sertifikat kami sangat penting bagi kami dan pelanggan kami. Kami mendukung hal ini dengan komitmen kami terhadap ketidakberpihakan dan kemandirian dalam pelaksanaan kegiatan sertifikasi kami.
Pilih bahasa
- Indonesia Bahasa Indonesia
- Global English
Halaman lokal
- Bosnia and Herzegovina Bosanski
- Bulgaria български
- China 简体中文
- Hong Kong 中文
- Taiwan 繁體中文
- Croatia Hrvatski
- Czech čeština
- UAE English
- Australia English
- Aserbaidschan English
- Egypt English
- Ethiopia English
- United Kingdom English
- Hong Kong English
- India English
- Global English
- Lebanon English
- Malaysia English
- Nigeria English
- Pakistan English
- United States English
- South Africa English
- Argentina Español
- Chile Español
- Colombia Español
- Spain Español
- Mexico Español
- El Salvador Español
- Iran ایرانی
- France Français
- Morocco Français
- Tunisia Français
- Germany Deutsch
- Hungary Magyar
- Italy Italiano
- Japan 日本語
- Korea 한국어
- Poland Polski
- Brazil Português
- Portugal Português
- Belarus Русский
- Russia Русский
- Serbia Srpski
- Slovakia Slovenský
- Turkey Türkçe
- Ukraine Українська
- Vietnam Tiếng Việt

Loading...
Ada Pertanyaan?
Kami siap membantu.